
Příprava alifatických aminů
Odvozeny od amoniaku náhradou atomů vodíku alkyly nebo aryly

CH3OH + NH3 -> CH3NH2 + H2O
(katalýza: Raneyův nikl)
R – CH = O + NH3 + H2 -> R- CH2 – NH2 + H2O
 Fyzikální
vlastnosti:
Fyzikální
vlastnosti:F CH3 – NH2
F CH3 – NH – CH3 plyny páchnoucí po rybách
F (CH3)3N
F Vyšší alifatické aminy + aminy aromatické: kapaliny
F Aminy odvozené od naftalenu: pevné krystalické
F Jedovaté!!!
F Karcinogenní:
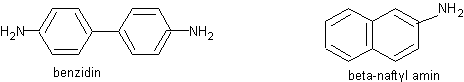
F Bazické:
S kyselinami reagují za vzniku solí: R-NH2 + H2O < --- > RNH3+ + OH-
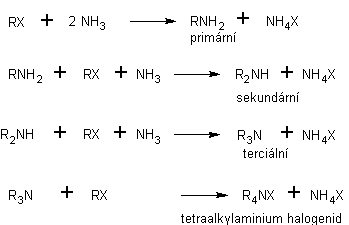
F Reakce s alkylhalogenidy:
RNH2 + RBr -> R2NH2Br dialkylamonium bromid
R2NH + RBr -> R3NHBr
R3N + RBr -> R4NBr tetraalkylamonium bromid
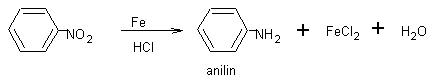
F Substituční reakce aromatických aminů
anilín + brom -> 2,4.6 tribrom anilín + bromovodík
|
Schématický zápis |
||||||||||||||||
|
||||||||||||||||
|
Podrobný zápis |
||||||||||||||||
| Kyselina dusitá vzniká reakcí dusitanu s HCl.HCl se jako kyselina chová i vůči kyselině dusité a tak vzniká nitrosyloxonium. | ||||||||||||||||
|
||||||||||||||||
| Nitrosyloxonium odštěpuje vodu a do reakce vstupuje anilin | ||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Výsledkem je žádaná diazoniová sůl. | ||||||||||||||||
|
| Ke kopulaci dochází u diazoniových solí zásluhou velké elektronové hustoty na 4, příp. 2 uhlíku druhé složky reakce. Diazoniová sůl je slabé elektrofilní činidlo a proto je třeba hustotu na příslušném uhlíku patřičně zvýšit . Reakce je Se (elektrofilní substituce). Druhou komponentu tvoří většinou aminosloučenina ( viz.methyloranž, methylčerveň, kongočerveň) a nebo fenol. | ||||||||||||||||||||||||
| Kopulace fenolů - schématický zápis | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Kopulace - podrobný zápis | ||||||||||||||||||||||||
| Pro rekci je třeba zásadité prostředí, aby se z fenolu stal fenolát, který způsobuje podstatně vyšší + M efekt | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Zásluhou +M efektu způsobeného volnými elektronovými páry na kyslíku fenolátu dochází k velkému zvýšení elektronové hustoty v polohách 2 a 4. Ze sférických důvodů v poloze 4 (v poloze 2 pak, pokud je poloha 4 obsazena) se chová dusík z diazoniové skupiny jako elektrofilní činidlo a napojuje se. Dochází tak v jedné části arénu k dočasnému porušení aromatického charakteru | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Protože je aromatické jádro velmi stabilním útvarem, dochází k jeho obnovení. Z tohoto důvodu se odpojuje vodíkový kationt na prvním uhlíku | ||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Anion přijímá vodíkový kation | ||||||||||||||||||||||||
|
| Diazotace - schématický zápis | |||||||||||||||
|
|||||||||||||||
| Pro podrobný zápis diazotace zde klikni | |||||||||||||||
| Kopulace - schématický zápis | |||||||||||||||
|
|||||||||||||||
| Kopulace - podrobný zápis | |||||||||||||||
| Zásluhou +M efektu způsobeného volným elektronovým párem na dusíku N,N-dimethylanilinu zesíleného navíc + I efekty methylových skupin dochází k velkému zvýšení elektronové hustoty v polohách 2 a 4 (klikni). Ze sférických důvodů v poloze 4 (v poloze 2 pak, pokud je poloha 4 obsazena) se chová dusík z diazoniové skupiny jako elektrofilní činidlo a napojuje se. Dochází tak v jedné části arénu k dočasnému porušení aromatického charakteru | |||||||||||||||
|
|||||||||||||||
| Protože je aromatické jádro velmi stabilním útvarem, dochází k jeho obnovení. Z tohoto důvodu se odpojuje vodíkový kationt na prvním uhlíku | |||||||||||||||
|
|||||||||||||||
| Vlastnosti indikátoru (formy methyloranže v závislosti na pH (mění se spolu s barvou při pH cca 4)): | |||||||||||||||
| Zásaditá forma (při pH větším než 4, to znamená ve vodě a v zásadě se chová indikátor jako kyselina)barva oranžová: | |||||||||||||||
|
|||||||||||||||
| Kyselá forma (při pH menším než 4, to znamená v kyselině se chová indikátor jako zásada) barva červená: | |||||||||||||||
|
| Diazotace - schématický zápis | |||||||||||||||
|
|||||||||||||||
| Pro podrobný zápis diazotace zde klikni | |||||||||||||||
| Kopulace - schématický zápis | |||||||||||||||
|
|||||||||||||||
| Kopulace - podrobný zápis | |||||||||||||||
| Zásluhou +M efektu způsobeného volným elektronovým párem na dusíku N,N-dimethylanilinu zesíleného navíc + I efekty methylových skupin dochází k velkému zvýšení elektronové hustoty v polohách 2 a 4 (klikni). Ze sférických důvodů v poloze 4 (v poloze 2 pak, pokud je poloha 4 obsazena) se chová dusík z diazoniové skupiny jako elektrofilní činidlo a napojuje se. Dochází tak v jedné části arénu k dočasnému porušení aromatického charakteru | |||||||||||||||
|
|||||||||||||||
| Protože je aromatické jádro velmi stabilním útvarem, dochází k jeho obnovení. Z tohoto důvodu se odpojuje vodíkový kationt na prvním uhlíku | |||||||||||||||
|
|||||||||||||||
| Vlastnosti indikátoru (formy methylčerveně v závislosti na pH (mění se spolu s barvou při pH cca 4)): | |||||||||||||||
| Zásaditá forma (při pH větším než 4, to znamená ve vodě a v zásadě se chová indikátor jako kyselina) barva oranžová | |||||||||||||||
|
|||||||||||||||
| Kyselá forma (při pH menším než 4, to znamená v kyselině se chová indikátor jako zásada) barva červená | |||||||||||||||
|
| Diazotace - schématický zápis | ||||||||||||||||
|
||||||||||||||||
| Pro podrobný zápis diazotace zde klikni | ||||||||||||||||
| Kopulace - schématický zápis | ||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Kopulace - podrobný zápis | ||||||||||||||||
| Zásluhou +M efektu způsobeného volným elektronovým párem na dusíku N,N-dimethylanilinu zesíleného navíc + I efekty methylových skupin dochází k velkému zvýšení elektronové hustoty v polohách 2 a 4 (klikni). Zde je poloha 4obsazena.Dusík z diazoniové skupiny se chová jako elektrofilní činidlo a napojuje se. Dochází tak v jedné části arénu k dočasnému porušení aromatického charakteru | ||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Protože je aromatické jádro velmi stabilním útvarem, dochází k jeho obnovení. Z tohoto důvodu se odpojuje vodíkový kationt na prvním uhlíku | ||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Vlastnosti indikátoru (formy červeňkonga v závislosti na pH (mění se spolu s barvou při pH cca 4)): | ||||||||||||||||
| Zásaditá forma (při pH větším než 4, to znamená ve vodě a v zásadě se chová indikátor jako kyselina) barva červená | ||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Kyselá forma (při pH menším než 4, to znamená v kyselině se chová indikátor jako zásada) barva modrá | ||||||||||||||||
|
||||||||||||||||
|
| Aminy (zde klik na aminy s triviálními názvy) | |||||||||||
| funkční skupina | obecně | příklady | |||||||||
|
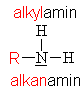 |
|
|||||||||
|
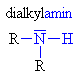 |
|
|||||||||
|
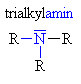 |
|
|||||||||
|
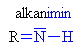 |
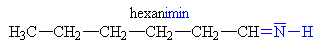 |
|||||||||
| Amidy | |||||||||||
|
|
||||||||||
|
|
||||||||||
|
|
||||||||||
| Nitrily | |||||||||||
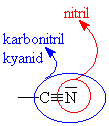 |
|
||||||||||
| Hydroxyly a oximy | |||||||||||
|
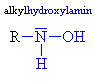 |
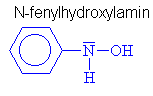 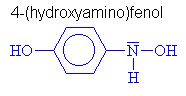 |
|||||||||
|
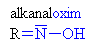 |
|
|||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
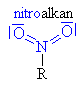
| Nitroso a nitrosloučeniny | |||||||||||
|
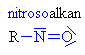 |
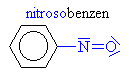 |
|||||||||
|
 |
|
|||||||||
| Laktamy a sultamy | |||||||||||
|
|||||||||||
Aminy s triviálními názvy
|
||||
|
||||
|
Názvosloví dvojdusíkatých
skupin
azosloučeniny,
azoxysloučeniny,
deriváty hydrazinu ,
hydrazony,
aziny
|
|||||||||
| V případě, že azo skupina spojuje dva stejné zbytky tvoří se název arenazo (příp.alkanazo), pokud je třeba, vyznačí se před azo čísla uhlíků na které se azo skupina váže. | |||||||||
|
|||||||||
| Pokud jsou zbytky substituovány, ale bez substituentů by byly stejné opět tvoří základ názvu arenazo (příp.alkanazo).Substituenty se doplňují obvyklým způsobem. Azo skupina je nadřazerná pro nejnižší číselná označení. | |||||||||
|
|||||||||
| V případě, že azo skupina spojuje dva rozdílné zbytky tvoří se název způsobem arenazoaren. Pokud je třeba vyznačit čísla uhlíků dávají se tato čísla bezprostředně k azo z té strany, kde je zbytek, který se označuje. | |||||||||
|
|||||||||
|
|||||||||
|
|||||||||
| Substituenty se doplňují obvyklým způsobem | |||||||||
|
|||||||||
| Bisazolátky se v případě, že nemá středovou složku a totožné skupiny, pojmenovává postupným citováním komponent, přičemž se začíná s nejsložitější jenotkou. | |||||||||
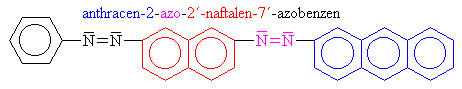 |
|||||||||
|
|||||||||
| Pokud to nepřekáží jednoznačnosti používá se zcela ekvivalentní pojmenování jako u azosloučenin, poze namísto azo-, se používá azoxy- | |||||||||
|
|||||||||
| Pokud to je nutné, musí se vyznačit, která skupina je blíže kyslíku. V případě, že jsou zbytky (nepočítaje substituenty) shodné uvede se NNO, je-li nečárkovaná část blíže kyslíku a ONN, je-li čárkovaná část blíže kyslíku | |||||||||
|
|||||||||
| V případě, že jsou zbytky různé uvede se ONN, je-li první z uvedených zbytků blíže uhlíku a NNO, je-li druhý z uvedených zbytků blíže k uhlíku | |||||||||
|
|||||||||
|
|||||||||
| Název se tvoří způsobem alkylhydrazin, resp. alkylarylhydrazin či arylarylhydrazin.Pokud je nutno zavést značení dusíků zavádí se N,N´, je však též povoleno značení 1,2. | |||||||||
|
|||||||||
| V případě, že je přítomna nadřazená skupina, uvádí se odvozenina od hydrazinu jako předpona hydrazino(dusík značený N se váže k nadřazené části) | |||||||||
|
|||||||||
| V případě, že se vážou (nepočítaje v to substituenty) dva stejné zbytky, tvoří se název ekvivalantně jako u azosloučenin. Jen se místo azo- použije hydrazo-. | |||||||||
|
|||||||||
| V případě, že se vážou dva různé zbytky, není ekvivalentní způsob s azosloučeninami povolen (alespoň podle mých informací). Jelikož je však v uvedeném případě jednodušší, uvedl jsem i takto vytvořený název pod vzorcem. | |||||||||
|
|||||||||
|
|||||||||
| Je zřejmé, že formálně vzniká hydrazon náhradou skupiny hydrazonové N-NH2 za kyslík (oxoskupinu) v aldehydu nebo ketonu. Proto se název tvoří tak,že se za název odpovídajícího aldehydu nebo ketonu přidá slovo hydrazon. Pokud v molekule existuje nadřazená skupina, pak se používá předpona hydrazono-. | |||||||||
|
|||||||||
| Kyseliny , příp.estery odvozené od hydrazonu | |||||||||
|
|||||||||
|
Názvosloví troj a
vícedusíkatých sloučenin
azidy,
azany
, amidhydrazony,
hydrazidin
,formazany
,semikarbazony
,bi a triuret
,
|
||||||||
|
||||||||
|
||||||||
|
||||||||
|
||||||||
|
||||||||
|
||||||||
|
||||||||
|