Halogenderiváty uhlovodíků
F
Halogenové
deriváty jsou sloučeniny obsahující jednovaznou skupinu halogenovou –X.
F
Je-li připojena
k acyklickému uhlovodíkovému zbytku, jde o alkylhalogenidy, pokud je
vázána přímo k aromatickému jádru, jde o arylhalogenidy.
F
Alkylhalogenidy
s vyjímkou těch, kde je halogenový atom připojen přímo k uhlíkovému
atomu násobné vazby, jak je tomu například u vinylchloridu CH2=CHCl, jsou
mnohem reaktivnější než arylhalogenidy. Pro týž uhlovodíkový zbytek stoupá
reaktivita od fluoridů k jodidům:
R¾F << R¾Cl < R¾Br < R¾I
F
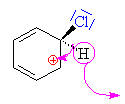
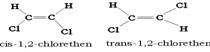
U halogenderivátů
existují dva typy izomerie: izomerie polohová např. 1-chlorpropan a
2-chlorpropan a izomerie geometrická, např. 1,2-dichlorethen:
Reakce
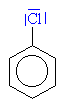
Elektrofilní substituce Chlorace benzenu
Zdroj: http://www.jergym.hiedu.cz/~canovm/
|
|||||||||||||||||||||||
|
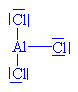
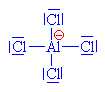
Chlorid hlinitý je Lewisova
kyselina a přijímá tudíž chloridový anion |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
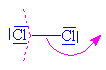
Vzniká chlorný
kation , který je elektrofilním činidlem |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
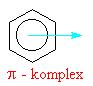
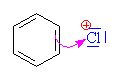
Chlorný
kation se napojuje na aromatický systém benzenu přes tzv. p komlex. Zjednodušeně a názorněji (i když
poněkud nepřesně) se dá říci, že na jednu z dvojných vazeb (konjugovaného 6
-ti elektronového systému) se napojuje elektrofilní činidlo |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
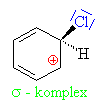
Aromatické jádro přestalo existovat, na sousedním uhlíku
od napadeného je kladný náboj (má pouze 3 vazby - 2 s uhlíky a jednu s
vodíkem)- vznikl tzv. s komlex , je
velká snaha obnovit stabilní aromatické jádro: |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
Při obnování stabilního aromatického jádra se odpojuje
vodíkový kation a jím uvolněná vazba se zapojuje do jádra a tak opětně vzniká
stabilní aromatický 6 elektronový kruh. Vznikl
chlorbenzen |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
Odštěpený vodíkový kation se napojuje na tetrachloridový
anion a za vzniku chlorovodíku
a chloridu
hlinitého (ten tedy slouží jako katalyzátor) se rozbíhá
další kolo reakce |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
F
Reakce
alkylhalogenidů mají většinou charakter nukleofilní substituce (hydroxidové
ionty napadají uhlíkový atom s částečným kladným nábojem za vzniku
nestálého bimolekulového komplexu, v němž přistupující skupina OH- není ještě zcela připoutána a
odstupující skupina I- odštěpena). A vedou k nejrůznějším derivátům. Proto
jsou důležitými výchozími sloučeninami organických syntéz.

F
Nukleofilní
substituce ethylbromidu:
o
CH3CH2¾Br ®OH-® CH3CH2¾OH + Br- ethanol
o
CH3CH2¾Br ®CH2CH2O-® CH3CH2¾O¾CH2CH3 + Br- diethylether
o
CH3CH2¾Br ®NH3® CH3CH2¾N+H3Br- ethylamoniumbrobid
o
CH3CH2¾Br ®CN-® CH3CH2¾CN + Br- ethylkyanid
o
CH3CH2¾Br ®SH-® CH3CH2¾SH + Br- ethanthiol
o
CH3CH2¾Br ®H-® CH3CH2¾H + Br- ethan
F
Při reakcích
nukleofilních činidel, která mají též zásaditý charakter, je substituce,
zejména substituce u terciárních halogenidů, provázena eliminací.
F
Alkyl- i
arylhalogenidy reagují v přítomnosti diethyletheru s hořčíkem za
vzniku velmi reaktivních organohořečnatých sloučenin, alkyl- nebo
arylmagnesiumhalogenidů (Grinardovy sloučeniny -podle objevitele). Kov je
v nich vázán přímo na uhlíkatý řetězec:
R¾X (halogenderyvát)
+ Mg®(C2H5)2O® R¾MgX (Grinardova sloučenina)
F
Methylchlorid,
chlormethan CH3Cl (g) se užívá jako náplň do chladicích zařízení a jako
methylační činidlo v organické syntéze.
F
Methylchlorid,
dichlormethan CH2Cl2 (l) je významné rozpouštědlo nepolárních sloučenin.
F
Chloroform,
trichlormethan CHCl3 (l) je rovněž rozpouštědlo nepolárních sloučenin. Dříve se
používal k narkózám.
F
Chlorid uhličitý,
tetrachlormethan CCl4 (l) slouží též jako rozpouštědlo a dřív byl používán jako
hasivo.
F
Trichlorethylen,
trichlorethen CCl2=CHCl (l) se používá k chemickému čištění.
F
Vinylchlorid,
chlorethen CH2=CHCl (l) je surovinou pro výrobu plastu polyvinylchloridu.
F
Chloropren,
2-chlor-1,3-butadien CH2=CClCH=CH2 (l) slouží k výrobě chloroprenového
kaučuku.
F
Chlorbenzen
C6H5Cl (l) je surovinou k syntézám mnoha aromatických sloučenin.
F
Tetrafluorethylen,
tetrafluorethen CF2=CF2 (g) se polymeruje na polytetrafluorethylen, jenž je
podstatou plastu teflonu.
F
Jodoform,
trijodmethan CHI3 (s) vzniká působením alkalického roztoku jodu na methylketony
nebo acetaldehyd. Má dezinfekční účinky.
F
Freony mají
nerozsáhlejší škodlivé důsledky v globálním měřítku ze všech
halogenderivátů). Jsou to plynné nebo kapalné chlorfluorderiváty methanu a
ethanu a našly rozsáhlé uplatnění pro svou stálost, nejedovatost a nehořlavost
v chladicí technice a jako hnací plyny v aerosolových výrobcích.
Jejich nebezpečí spočívá v jejich stálosti. Jeden radikál chloru může
rozštěpit až 100 000 molekul O3.
F
CCl3F ®UV®CCl2F× + ×Cl ×Cl + O3 ® ClO× + O2
Souhrn
F
význam -
rozpouštědla, insekticidy, plastické hmoty, chladírenství
F
vliv na přírodu a
živé organismy, pojem kumulativní jed
F
charakteristické
reakce, příprava a výroba, představitelé
F
kapaliny, rozpouštědla,
v přírodě se nevyskytují, vyrábí se synteticky, působí jako kumulativní jedy,
nerozpouštějí se ve vodě, ale v tucích, hromadí se v těle živočichů, jsou
významné v průmyslu
F
jsou to
sloučeniny obsahující jednovaznou skupinu halogenovou -X - ta je buď připojena
k acyklickému uhlovodíkovému zbytku - alkylhalogenidy, nebo je navázána přímo k
aromatickému jádru - arylhalogenidy
F
alkylhalogenidy
jsou mnohem reaktivnější než arylhalogenidy, pro týž uhlovodíkový zbytek stoupá
reaktivita od fluoridů k jodidům: R-F << R-Cl < R-Br < R-I
F
reakce
alkylhalogenidů mají většinou charakter nukleofilní substituce a vedou k
nejrůznějším derivátům
F
![]() alkyl-
i arylhalogenidy reagují v přítomnosti diethyletheru s hořčíkem za vzniku velmi
reaktivních organohořečnatých sloučenin - Grignardovy sloučeniny - kov je v
nich vázán přímo na uhlíkatý řetězec: R-X + Mg diethylether R-MgX (Grignardova
sloučenina)
alkyl-
i arylhalogenidy reagují v přítomnosti diethyletheru s hořčíkem za vzniku velmi
reaktivních organohořečnatých sloučenin - Grignardovy sloučeniny - kov je v
nich vázán přímo na uhlíkatý řetězec: R-X + Mg diethylether R-MgX (Grignardova
sloučenina)
F
primární sekundární terciární
F
příprava:
halogenovodík + nenasycený uhl.
F
Eliminace,
substituce:
F
methylchlorid, chlormethan CH3Cl (g) - užívá se jako náplň do chladících zařízení a jako
methylační činidlo v organické syntéze
F
methylendichlorid, dichlormethan CH2Cl2 (l) - významné rozpouštědlo nepolárních
sloučenin
F
chloroform, trichlormethan CHCl3 (l) - rozpouštědlo nepolárních sloučenin, dříve se užíval k
narkózám
F
chlorid uhličitý, tetrachlormethan CCl4 (l) - rozpouštědlo, dříve používán k hašení
F
trichlorethylen, trichlorethen CCl2=CHCl (l) - užívá se k chemickému čištění
F
vynilchlorid, chlorethen CH2CHCl (g) -surovinou pro výrobu PVC
F
chloropren,
2-chlor-1,3-butadien CH2CClCH=CH2 (l) - slouží k výrobě chloropropenového
kaučuku
F
chlorbenzen
C6H5Cl (l) - surovinou k syntézám mnoha aromatických sloučenin
F
tetrafluorethylen,
tetrafluorethen CF2=CF2 (g) - polymeruje se na polytetrafluorethylen - teflon -
snáší vysoké teploty
F
jodoform,
trijodmethan CHI3 (s) - vzniká působením alkalického roztoku jodu na
methylketony nebo acetaldehyd, je žlutý, voní po šafránu a má dezinfekční
účinky
F
bromoform,
tribrommethan CHBr3 - uklidňuje kašel
F
DDT,
dichlórdifenyltrichlórethan - pesticid, kumulovaný jed