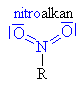
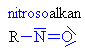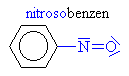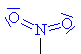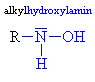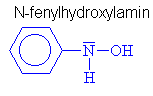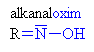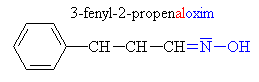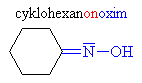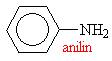Nitrosloučeniny
= dusíkaté sloučeniny
Příprava
F Nitrací (= HNO3 působí na uhlovodíky)
F
 Alkylací dusitanu sodného (dusitan sodný je NaNO2)
Alkylací dusitanu sodného (dusitan sodný je NaNO2)
![]() Nitrace=
substituční reakce
Nitrace=
substituční reakce
- Alifatické uhlovodíky se nitrují takto: CH4 + HNO3 -> CH3NO2 + H2O (teplota okolo 400 oC)
- Alicyklické nasycené uhlovodíky
- Aromatické uhlovodíky
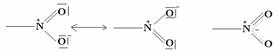
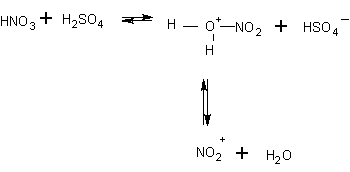
– nitrace: mechanismus iontový elektrofilní
Mechanismus radikálový:
CH4 + HNO3 -> CH3NO2 + H2O
Iniciace: RH + -NO2 -> R- + HNO2
Propagace: R- + HNO3 -> R-NO2 + -OH
HO- + RH -> R- + H2O
Při nitraci vyšších uhlovodíků dochází ke štěpení řetězce (nejspíš to bude teplotou, která je při této reakci dost vysoká, viz výše):
CH3 – CH2 – CH3 + HNO3 -> CH3 – CH2 – CH2 – NO2 1- nitropropan
->
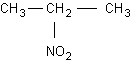 2- nitropropan
2- nitropropan
-> CH3 – CH2 –NO2 nitroethan
-> CH3 –NO2 nitromethan
Produkty se oddělují destilací (neb mají rozdílné body varu)
Alkylace dusitanu sodného alkylhalogenidy
(= příprava v laboratoři)
CH3 – (CH2)4 – CH2 –I + NaNO2 -> CH3 – (CH2)4 – CH2 – NO2 + CH3 – (CH2)4 – CH2 – O – N = O + NaI
1 – jod hexan (nebo hexyljodid) 1-nitrohexan hexylnitrit
Substituce elektrofilní
(=nitrace aromatických uhlovodíků)
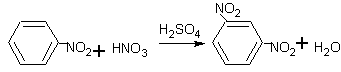
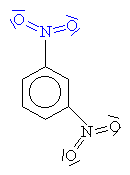
nitrobenzen 1,3-
dinitrobenzen
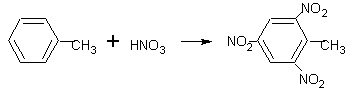
Toluen trinitrotoluen = T.N.T = výbušnina (z T.N.T. se dále vyrábí dynamit)
Nitrační směs = HNO3 +H2SO4
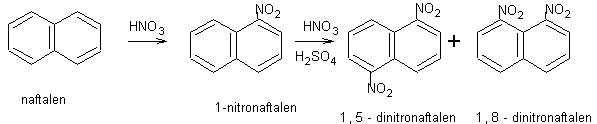
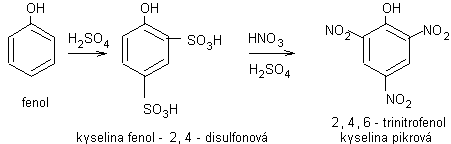
nitrace fenolů
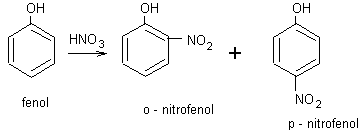
nitrace fenolu do 3. stupně
– trik:
Vlastnosti a význam nitroderivátů
F Alifatické: slabě páchnoucí, bezbarvé nebo nažloutlé kapaliny
F Aromatické: kapaliny (případně krystalické látky) hořkomandlového zápachu
F Jedovaté, často insekticidy
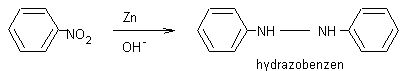
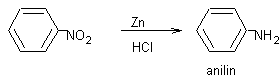
F Snadná redukce:
F V zásaditém prostředí
F V kyselém prostředí
Zástupci nitrosloučenin
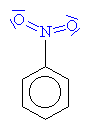
Nitrobenzen
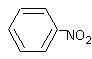
F Bezbarvá olejovitá kapalina
F Rozpouštědlo
F Použití při výrobě anilínu
Kyselina pikrová
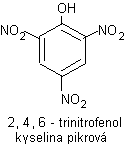
F Žlutá krystalická látka
F Hořká chuť (pikros = hořký)
F Trhavina
Názvosloví
Nitroso a nitrosloučeniny
|
|
|
||||||
|
|
|
||||||
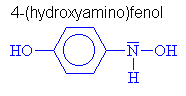
Hydroxyly a oximy
|
||||||||
|
|
|
||||||
|
|
|
||||||
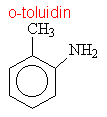
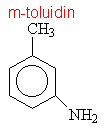
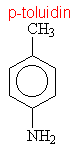
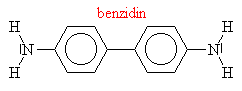
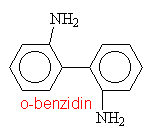
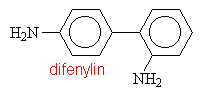
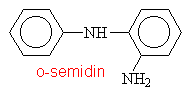
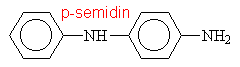
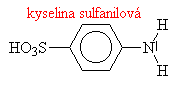
Aminy s triviálními názvy
|
||||
|
||||
|