Základní poznatky
pro výpočet z chemických rovnic
Zdroj: http:/xantina.hyperlink.cz/
Atomová
hmotnost
Jednotlivé atomy, molekuly, ionty mají
velice malou hmotnost, např. atom vodíku váží 1,663 . 10-
Atomová hmotnostní jednotka rovná se 1/12 hmotnosti atomu
Atomová hmotnost prvku je průměrná hmotnost jeho
atomů, vyjádřena v jednotkách atomové hmotnosti (u).
Př.: atomová hmotnost lithia je 6,94 u (údaj bereme z
periodické tabulky).
Relativní
atomová hmotnost
Relativní
atomová hmotnost prvku (Ar) je číslo, které vyjádřuje
poměr průměrné hmotnosti atomů k jednotce atomové hmotnosti (tj. k hmotnosti
1/12 atomu
|
Ar(H) |
= |
1,007 9 |
|
Ar(He) |
= |
4,022 60 |
Molekulová hmotnost látky je součet
atomových hmotností prvků, které tvoří molekulu, podle jejich poměrného
zastoupení.
Př.:
|
atomová hmotnost vodíku . . . . . . . . . . . . . . . . . . . |
1,008 u |
|
molekulová hmotnost vodíku je (2. 1,008 =) . . . . |
2,016 u |
Relativní
molekulová hmotnost
Relativní molekulová hmotnost látky je
součet relativních atomových hmotností prvků, které tvoří molekulu, podle
jejich poměrného zastoupení. Je to tedy číselný údaj molekulové hmotnosti bez
označení u.
Př.:
|
molekulová hmotnost fluoru . . . . . . . . . . . . . . . . . |
38,00 u |
|
relativní molekulová hmotnost fluoru . . . . . . . . . . |
38,00 |
Z chemického hlediska je vhodnější srovnávat
množství látek na základě počtu jejich atomů nebo molekul. Základní jednotkou
látkového množství je mol.
Jeden mol jakékoli látky obsahuje 6,023 . 1023
částic (atomů, molekul, iontů).Hmotnost jednoho molu (tj. 6,023 . 1023
částic) látky vyjadřená v gramech má název molární
hmotnost. Číselně je molární hmotnost rovna relativní molekulové (atomové) hmotnosti,
ale liší se od ní tím, že má rozměr g . mol-1.
Př.:
|
Kyslík O2 |
|
|
1 mol O2 obsahuje . . . |
6,023 . 1023 molekul O2 |
|
1 mol O2 váží . . . . . . . |
|
|
1 mol O2 má objem . . |
Mezi látkovým množstvím n (v
molech), hmotností látky m (v gramech) a molární hmotností M (v g
. mol-1) platí vztah:
![]()
Př 1: Vypočtěte, kolik molů obsahuje
kyselina sírová o hmotnosti
1) Pro výpočet použijeme výše uvedený vztah.
2) Známe: m =
3) Dosadíme známé hodnotý do vzorce:
|
n = |
49,05 |
|
98,1 |
n = 0,5 molu
Odpověď:
Př 2: Kolik váží 3 moly HCl?
m = ? g, M(HCl) =
|
3 = |
m |
|
36,46 |
m =
Odpověď: 3 moly chlorovodíku váží
Hmotnostní
zlomek
Hmotnostní zlomek wA
udává relativní zastoupení látky A v roztoku a je definován jako podíl
hmotnosti látky mA k celkové
hmotnosti roztoku mR:
![]()
|
mR = mA + mr |
|
|
mA - |
hmotnost látky A |
|
mr - |
hmotnost rozpouštědla |
|
mR - |
hmotnost roztoku |
Př :
Vypočtěte, jaky je hmotnostní
zlomek vodného roztoku chloridu sodného, který byl připraven rozpuštěním
|
1) Výjdeme ze vztahu |
|
|
2) Známe: |
mNaCl = |
|
mr = |
|
|
mR = 85 + 15 = |
1) Dosadíme do vzorce
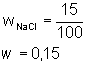
Odpověď: hmotnostní zlomek vodného roztoku chloridu sodného je 0,15.
Hmotnostní
procento
Hmotnostní procento látky A v roztoku získáme vynásobením jejiho hmotnostního zlomku stem:
![]()
Př:
V kolika g vody je nutno rozpustit
|
2) Známe: |
mNaCl = |
|
hmot. % = 20% |
2) Dosadíme do vzorce
3)
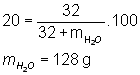
Odpověď: aby vznikl 20% roztok chloridu sodného je nutno rozpustit
Výpočty procentového
složení látky
Tento druh výpočtu nám dovolí určit
procentové zastoupení prvků v molekule.
Př. 1: Jaké je procentové složení vody?
1. Zjistíme molekulovou
hmotnost vody H2O (pro naše výpočty zaokrouhlíme na celá
čísla);
|
atomová hmotnost 2 H |
. . . |
2 u |
|
atomová hmotnost O |
. . . |
16 u |
|
molekulová hmotnost H2O |
. . . |
18 u |
2. Řešíme úměrou:
|
18 u vody je |
. . . |
100 % |
|
16 u kyslíku je |
. . . |
x % |
|
x = 100 . 16 : 18 |
|
x = 88,9 % |
Voda obsahuje 88,9 % kyslíku.
|
18 u vody je |
. . . |
100 % |
|
2 u vodíku je |
. . . |
y % |
|
y = 100 . 2 : 18 |
|
y = 11,1 % |
Voda obsahuje 11,1 % vodíku.
Odpověď: molekula vody obsahuje 88,9 % kyslíku a 11,1 % vodíku.
Př. 2: Vypočítejte procentové složení oxidu hlinitého.
1.
|
atomová hmotnost 2 Al |
. . . |
53,96 u |
|
atomová hmotnost 3 O |
. . . |
48 u |
|
molekulová hmotnost Al2O3 |
. . . |
101,96 u |
2.
|
101,96 u Al2O3 je |
. . . |
100 % |
|
101,96 u Al2O3 je |
. . . |
100 % |
|
53,96 u 2 Al je |
. . . |
x % |
|
48 u 3 O je |
. . . |
y % |
|
x = 100 . 53,96 : 1,01,96 |
|
y = 100 . 48 : 1,01,96 |
|
|
||
Odpověď: oxid hlinitý obsahuje 52,92 % a 47,08 % kyslíku.